Kleine Teilchen – große Gefahr?
Mikroplastikpartikel aus Kosmetikprodukten oder abradierte Fasern gelangen z. B. über Klärschlamm auf landwirtschaftliche Nutzflächen. Da über die Auswirkungen von Mikroplastik auf das terrestrische Ökosystem wenig bekannt ist, beschäftigt sich diese Arbeit mit der Etablierung und Durchführung eines Experiments mit Eisenia fetida zur Untersuchung der Wirkung von Mikroplastik auf terrestrische Organismen.
1.1 Mikroplastik in aquatischen und terrestrischen Ökosystemen
Im internationalen Jahr des Bodens 2015 rückte die Bedeutung der Bedrohung des terrestrischen Ökosystems unter anderem durch Plastikabfälle in das öffentliche Bewusstsein. Kunststoffe gehören jedoch zu unserem täglichen Leben. Sie sind in vielfältigen Begleitern des Alltags wie Plastiktüten, Verpackungen und Kosmetika enthalten. Durch das achtlose Wegwerfen von Kunststoffprodukten werden die Umwelt und die darin lebenden Organismen langfristig geschädigt. In die Umwelt eingebrachter Kunststoff altert u. a. durch UV-Strahlung und mechanischen Abrieb. Dabei wird der Kunststoff spröde und zerfällt in immer kleinere, unregelmäßige Fragmente. Ein vollständiger Abbau von Kunststoffen erfolgt, wenn überhaupt, nur sehr langsam – über Jahrhunderte. Die Kunststoffabfälle werden in verschiedene Größenklassen (Makro-, Meso- und Mikroplastik) eingeteilt. Die Mikroplastik-Partikel (Partikel kleiner als 5 mm) werden in primäres und sekundäres Mikroplastik unterteilt. Als primäres Mikroplastik bezeichnet man Kunststoffe, die speziell zum Beispiel für die Verwendung in Kosmetikprodukten hergestellt werden, sekundäres Mikroplastik entstammt ursprünglich größeren Kunststoffprodukten, die durch Alterungsprozesse und durch Abrieb zu Partikeln kleiner 5 mm werden.
Über den Einfluss von Mikroplastik im terrestrischen Ökosystem liegen nur wenige Untersuchungen vor. Obwohl aquatische und terrestrische Ökosysteme funktionell übereinstimmen, stellen beide Ökosysteme gegensätzliche Typen dar [10].
Um die Gefährdung dieses für den Menschen lebensnotwendigen Systems in das öffentliche Bewusstsein zu rücken, wurde das Jahr 2015 von der Generalversammlung der Vereinten Nationen zum Internationalen Jahr des Bodens erklärt [8]. Es ist zu bedenken, dass es in einer Handvoll Humusboden mehr Lebewesen als Menschen auf der Erde gibt. Das Trockengewicht dieser Bakterien, Pilze, Würmer, Spinnen, Insekten und Einzeller beträgt pro Hektar etwa 5 Tonnen [4]. Bestimmte Testorganismen, wie zum Beispiel der Kompostwurm Eisenia fetida, werden genutzt, um Schäden in diesem empfindlichen Ökosystem zu erkennen.
Mikroplastik gelangt zum Beispiel durch Düngung landwirtschaftlicher Flächen mit Klärschlamm, aber auch durch die landwirtschaftliche Verwendung von Gärabfällen aus Biogasanlagen sowie durch Reifenabrieb in das terrestrische Ökosystem. Der Gehalt an Mikroplastik im Klärschlamm kommunaler Kläranlagen wurde 2014 durch das Alfred-Wegener-Institut untersucht (Mikroplastik in ausgewählten Kläranlagen des Oldenburgisch-Ostfriesischen Wasserverbandes (OOWV) in Niedersachsen, Alfred-Wegener-Institut, Biologische Anstalt Helgoland, 2014, Seite 1–48, [7]). Dabei fanden sich, in Abhängigkeit von der Effizienz der Kläranlage, zwischen 1041 und 24 129 Mikroplastik-Partikel pro Kilogramm Trockenmasse Klärschlamm. Es wurden insgesamt vier verschiedene Kunststoffarten identifiziert. Es dominierten Partikel aus Polyethylen (PE) und Polypropylen (PP), gefolgt von Polystyrol (PS) und Polyamid (PA). Es handelt sich dabei zum einen um speziell angefertigte Mikroplastik-Partikel aus Kosmetikprodukten in einer Größe zwischen wenigen Mikrometern und einigen Millimetern, zum anderen abradierte Mikroplastik-Fasern mit einer Größe zwischen 50 und 100 μm von Fleece- Kleidungsstücken [2].
Nimmt man ein Mikroplastik-Partikelgewicht von 1,8 mg an (Analysen-Proben MED-Expedition: Ifremer, Uni Liege, [9]) und legt die gefundenen 1041 bis 24 129 Mikroplastik-Partikel pro Kilogramm Trockenmasse Klärschlamm zugrunde, dann betrüge hochgerechnet der Gehalt an Mikroplastik zwischen 1,8 g und 43,2 g pro Kilogramm Klärschlamm.
Bei maximaler Ausnutzung der gesetzlich erlaubten 1,67 Tonnen Klärschlamm Trockenmasse pro Hektar Ackerfläche pro Jahr würden zwischen 3,0 kg und 72,1 kg Mikroplastik pro 10.000 m2 Ackerboden ausgebracht. Das entsprächen 0,3 g bis 7,2 g Mikroplastik pro Quadratmeter und Jahr, die auf die Bodenorganismen einwirken können.
1.2 Ziel und Vorgehen
Ziel der vorliegenden Arbeit ist, anhand des Testorganismus Eisenia fetida die Auswirkung von Mikroplastik auf das terrestrische Ökosystem näher zu untersuchen. Meine Hypothese ist, dass unter dem Einfluss der Mikroplastik- Partikel sich ein oder mehrere spezifische Testparameter im Sinne einer Schädigung auf Eisenia fetida pathologisch verändern.
Dazu wird der Abrieb einer häufig vorkommenden Kunststoffart (Polypropylen) in verschiedenen Konzentrationen dem Futter des Testorganismus zugesetzt, um die oben beschriebene reale Umweltsituation zu simulieren.
Über eine Gesamt-Versuchsdauer von 56 Tagen wird anhand verschiedener Messparameter, wie zum Beispiel Mortalität und Fertilität, die Auswirkung von Mikroplastik auf Eisenia fetida ermittelt.
Zur Unterstützung der Hypothese, dass sich Mikroplastik im Darm von Eisenia fetida anlagert, werden die Würmer in einem Zusatzexperiment mit fluoreszierendem Mikroplastik gefüttert. Dazu steht fluoreszierendes Polyamid (Prof. G. Schulz, Hochschule Reutlingen) zur Verfügung. Polyamid gelangt in signifikanten Mengen durch Abrieb von z. B. Fleecepullis in das terrestrische Ökosystem.
Die Experimente mit Eisenia fetida werden entsprechend den OECD-Richtlinien für die Testung von Chemikalien durchgeführt. Zur Anwendung kommt die OECD-Guideline Nr. 222, der sogenannte „Earthworm Reproduction Test“. Die Versuchstiere werden von der Firma IBACON, Roßdorf, zur Verfügung gestellt. Zu Versuchsbeginn sind die Tiere ein Jahr alt.
Es werden jeweils zehn adulte Würmer in jeweils ein Versuchsgefäß gesetzt. Der Versuchsansatz besteht aus 28 Versuchsgefäßen und insgesamt 280 Versuchstieren:
Die Kontrollgruppe (ohne Mikroplastik- Zusatz) besteht aus acht Versuchsgefäßen (insgesamt 80 Versuchstiere). Jede der fünf Versuchsgruppen mit unterschiedlichen Konzentrationen an Mikroplastik besteht aus je vier Versuchsgefäßen (jeweils 40 Versuchstiere). Die Raumtemperatur beträgt 20 +/– 2° Celsius. Der Versuch wird unter kontrollierten Hell-Dunkelzyklen (16 Stunden hell, 8 Stunden dunkel) durchgeführt.
Als Versuchssubstrat wird künstliche Erde nach den OECD-Richtlinien hergestellt. Das sogenannte Grundsubstrat besteht aus 69,6 % Quarzsand (Quarzwerke Frechen, F 34), 20 % Kaolin (Firma Erbslöh, Lohrheim), 10 % Torf (Floragard, nach DIN 11540) und 0,4 % Kalk (Firma Merck, Darmstadt). 500 g trockene Grundsubstanz werden in jeweils ein Versuchsgefäß gegeben und mit 147,5 g Wasser durchfeuchtet. Das Grundsubstrat hat 59 % Wasserhaltekapazität. Die Befeuchtung soll 50 % von diesen 59 % = 29,5 % betragen, d. h. 295 g Wasser auf 1000 g Grundsubstrat. Die Versuchsgefäße sind Kunststoffschalen mit einer Kapazität von 2 Litern, einer Oberfläche von 200 cm2 und einer Tiefe von 4,5 cm. Während des Versuches sind die Versuchsgefäße mit transparenten Kunststoffdeckeln verschlossen. Diese enthalten zum Gasaustausch zwanzig runde Öffnungen (Durchmesser 0,5 mm).
Abb. 1 zeigt die Anordnung der Versuchsgefäße, gefüllt mit Grundsubstrat. In der vorderen Reihe wurde bereits Wasser hinzugefügt.
Am Tag vor Versuchsbeginn werden 400 Würmer (> 5 cm) aus den Anzuchtboxen herausgelesen und zur Akklimatisierung für 24 Stunden in eine Box mit 1 kg angefeuchtetem Versuchssubstrat ohne Futter gesetzt.
An Tag 0 des Versuchs werden geschlechtsreife Würmer, erkennbar an einem Clitellum (siehe Abb. 2), aussortiert und in einem Küchensieb unter fließendem Wasser von anhaftender Erde gesäubert.
Jeder Wurm wird vor dem Wiegen durch kurzes Auflegen auf Küchenkrepp von Wasser befreit, sodass die Haut noch glänzt, aber nicht mehr tropfnass ist. Das individuelle Wurmgewicht sollte zwischen 200 und 600 mg liegen. Um die Verteilung der Versuchstiere zu den Versuchsgruppen zufällig zu gestalten, erfolgt die Zuordnung der gewogenen Versuchstiere für die ersten 28 Tiere aufsteigend (von Versuchsgefäß 1 bis 28), für die folgenden 28 Tiere absteigend (Gefäß 28 bis 1), für die nächsten 28 Tiere wieder aufsteigend, und so fort.
Jeweils 5 g gemahlener Kuhdung (von der Firma IBACON) wird erstmals am Tag 1 nach dem Versuchsbeginn auf die Oberfläche des Substrats in jedem Versuchsgefäß aufgebracht, danach alle 7 Tage für insgesamt 28 Tage. Das frisch aufgebrachte Futter wird mit jeweils 2 g Wasser besprüht.
Der Wasserverlust des Substrats durch Verdunstung durch die Deckelöffnungen der Testgefäße wird dabei durch Wiegen des Versuchsgefäßes kontrolliert. Verluste werden durch Wasserzugabe ergänzt.
Am Tag 28, nach Entfernen der adulten Würmer, werden die Substratoberflächen wiederum alle 7 Tage bis Tag 56 mit jeweils 5 g gemahlenen Kuhdung bestreut.
Mikroplastik wird nur einmalig mit der ersten Fütterung der Versuchstiere zugeführt: Feingeriebenes Polypropylen (PP) wird mit 5 g Kuhdung vermischt und jeweils auf der Oberfläche des Grundsubstrats verteilt. Die Mikroplastik- Partikel weisen maximal dieselbe Größe wie die Kuhdung-Partikel auf (siehe Abb. 3).
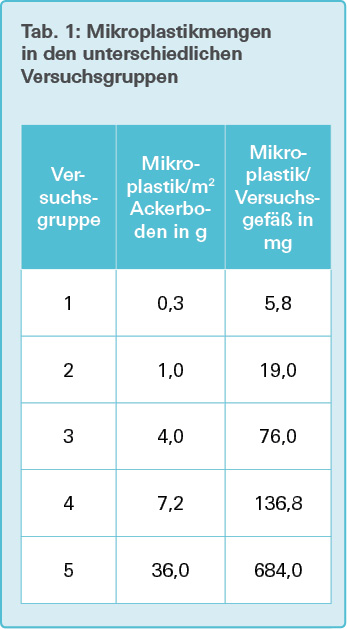
Für die Errechnung der für unsere Versuche notwendigen Mikroplastik- Mengen legten wir die in der Einleitung genannten Werte [7] zugrunde. Die Oberfläche des Grundsubstrates im Versuchsgefäß beträgt 0,019 m2. Damit enthalten die unterschiedlichen Versuchsgruppen die in Tab. 1 genannten Mikroplastikmengen. Als höchste Testdosis wird bei toxikologischen Experimenten das Fünffache der höchsten, in der Realität vorkommenden Dosis der zu testenden toxischen Substanz eingesetzt.
Am Tag 28 wird jedes Versuchsgefäß einzeln geleert und die adulten Würmer herausgelesen. Nach Reinigung unter fließendem Wasser und Abtupfen mit Küchenkrepp werden die Würmer einzeln gewogen. Für diese Versuchstiere ist das Experiment beendet, sie werden im Garten freigesetzt.
Das Grundsubstrat mit den darin enthaltenen Eiern von Eisenia fetida (siehe Abb. 4) wird zur Fortführung des Experimentes wieder zurück in das Versuchsgefäß gegeben.
Nach weiteren 28 Tagen wird jedes Versuchsgefäß in einem Wasserbad für 30 Minuten bei 55° Celsius erwärmt. Durch die Wärme werden die im Erdreich befindlichen Jungtiere an die Oberfläche getrieben und können dort gezählt werden.
Es wurden folgende Parameter gemessen.
- Fraßrate: Abschätzung, inwieweit die Oberfläche des Substratbodens jeweils 7 Tage nach vorangegangener Fütterung noch mit Kuhdung bedeckt ist (schlecht quantifizierbarer, weicher Parameter)
- Mortalität: Prüfung der Anzahl der überlebenden adulten Versuchstiere. Die Konzentration der Testsubstanz sollte so gewählt werden, dass kein Versuchstier innerhalb der 28 Tage verstirbt.
- Gewichtsdifferenz: Gewichtsentwicklung der adulten Tiere während der 28-tägigen Versuchsdauer, bestimmt aus den Gewichtsbestimmungen an Versuchstag 0 und 28. Da individuelle Tiere nicht unterschieden werden können, wird die Gewichtsdifferenz pro Versuchsgefäß mit je 10 Würmern angegeben.
- Fertilität: Anzahl der Jungtiere pro Versuchsgefäß nach 56 Tagen Versuchsdauer (härtester Parameter).
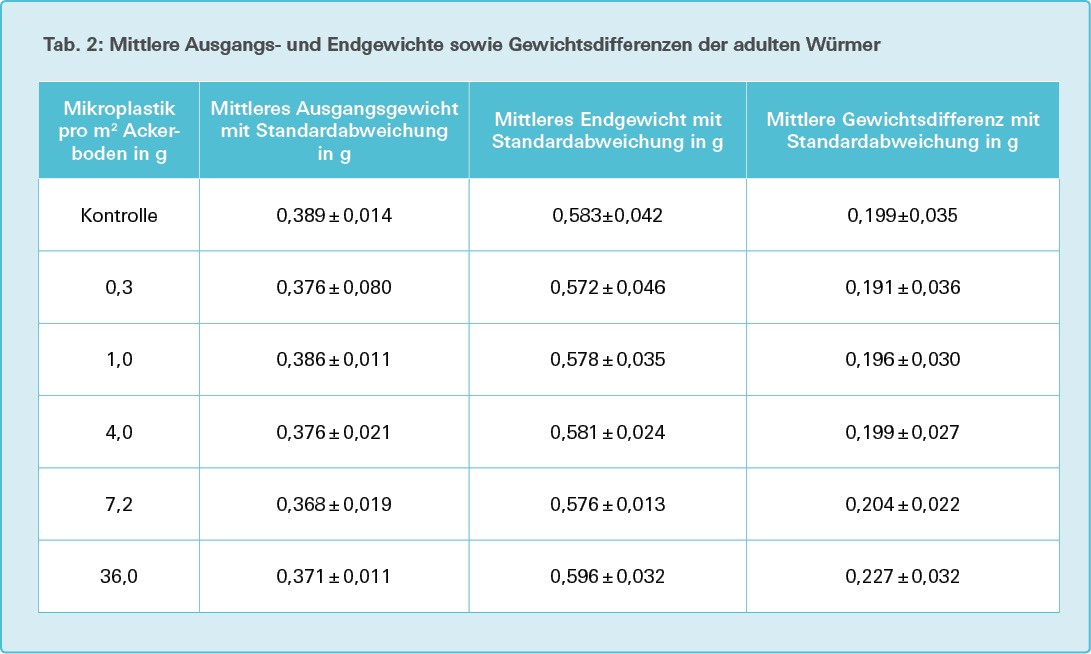
Von jeder Versuchsgruppe werden der Mittelwert und die Standardabweichung der Gewichte zu Versuchsbeginn (Tag 0) und Versuchsende für Adulttiere (Tag 28) errechnet.
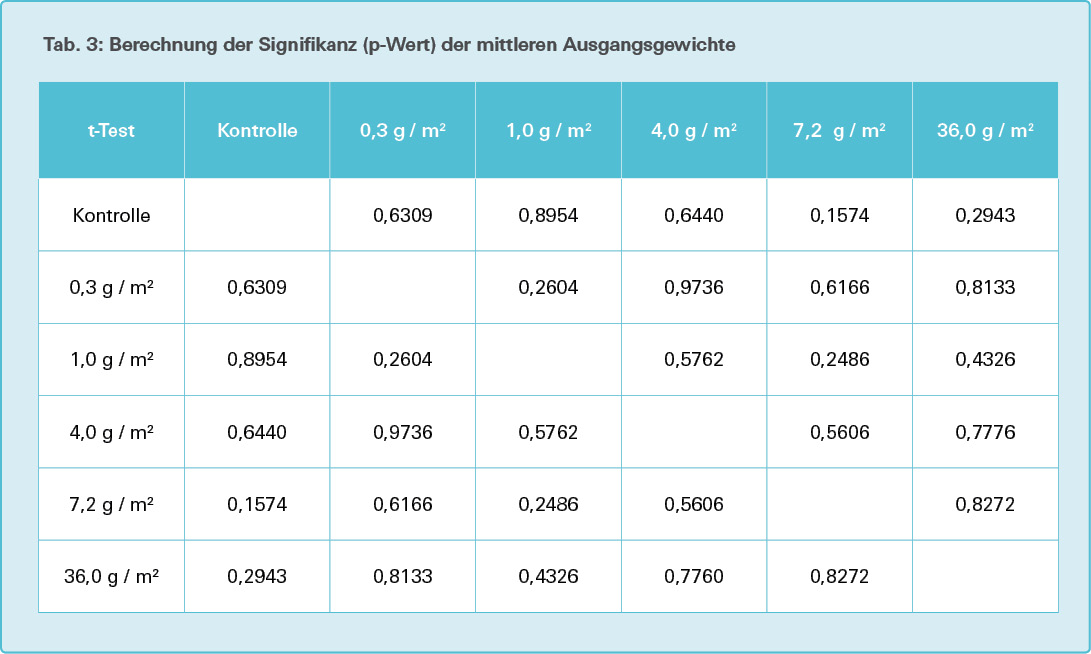
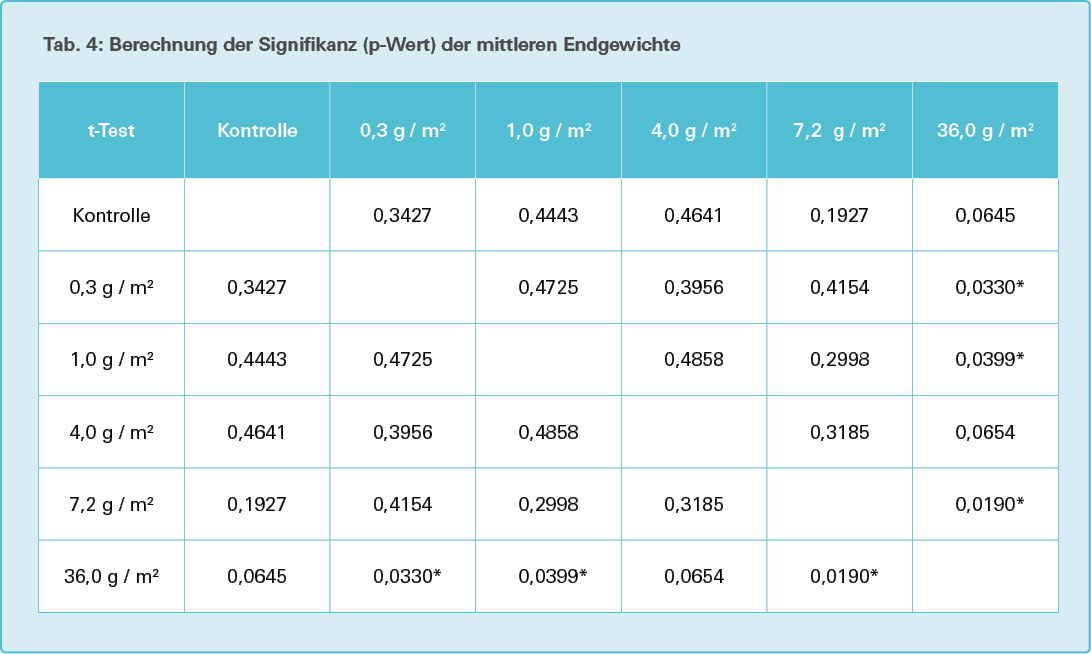
Zur Ermittlung der Signifikanz (Signifikanzniveau p = ,05) wird der Zweistichproben- t-Test für unabhängige Stichproben (ungepaarter t-Test) angewandt [11].
Es werden wiederum jeweils 10 adulte Würmer in jeweils ein Versuchsgefäß gesetzt. Der Versuchsansatz besteht diesmal aus vier Versuchsgefäßen mit insgesamt 40 Versuchstieren. Die Kontrollgruppe (ohne fluoreszierendes Mikroplastik) besteht aus zwei Versuchsgefäßen (insgesamt 20 Versuchstiere). Zwei Versuchsgruppen mit dem fluoreszierenden Mikroplastik bestehen ebenfalls aus zwei Versuchsgefäßen (jeweils 20 Versuchstiere). Die übrigen Parameter entsprechen den oben genannten Bedingungen.
Das fluoreszierende Mikroplastik (feingemahlenes Polyamid in der Größe 20 μm x 500 μm) wird in der Menge von 76,0 mg (entspricht 4,0 g Mikroplastik pro m2 Ackerboden) bzw. 684,0 mg (entspricht 36,0 g Mikroplastik pro m2 Ackerboden) mit 5 g Kuhdung vermischt und jeweils auf der Oberfläche des Grundsubstrats verteilt.
Bei den Fütterungen alle sieben Tage hat die Menge des bei der vorangegangenen Fütterung aufgebrachten Kuhdungs auf der Oberfläche jedes der Versuchsgefäße deutlich abgenommen. Nach Augenschein ergibt sich zwischen den Kontroll- sowie den Versuchsgruppen kein Unterschied in der Fraßrate. Inwieweit Mikroplastik von den Versuchstieren aufgenommen wird, kann aufgrund der geringen Partikelgröße und der Vermischung mit dem Dung nicht quantifiziert werden.
In jedem der Versuchsgefäße finden sich nach 28 Tagen 10 lebende adulte Würmer, die Mortalität beträgt in allen untersuchten Gruppen Null. In der ausgebreiteten Erde finden sich diverse Eier, jedoch noch keine Jungtiere.
Auf der Basis eines Signifikanzniveaus von 5 % weisen die Ausgangsgewichte der Versuchstiere (Tab. 2) in den Versuchsgruppen keinen signifikanten Unterschied zu denen der Kontrollgruppe auf (Tab. 3, in jedem der Gruppenvergleiche p > 0,05).
Die Endgewichte der Versuchstiere (siehe Tab. 2) in der 36,0-g/m2-Versuchsgruppe weisen gegenüber der 0,3-g/m2-, der 1,0- g/m2- sowie der 7,2-g/m2-Versuchsgruppe einen signifikanten Unterschied (signifikant höheres Endgewicht, p < 0,05) auf, die Signifikanz wird gegenüber der Kontrollgruppe sowie der 4,0-g/m2-Versuchsgruppe knapp verfehlt (p = 0,065), siehe Tab. 4. Zwischen allen anderen Versuchsgruppen wird ein signifikanter Unterschied im Endgewicht deutlich verfehlt (p >> 0,05).
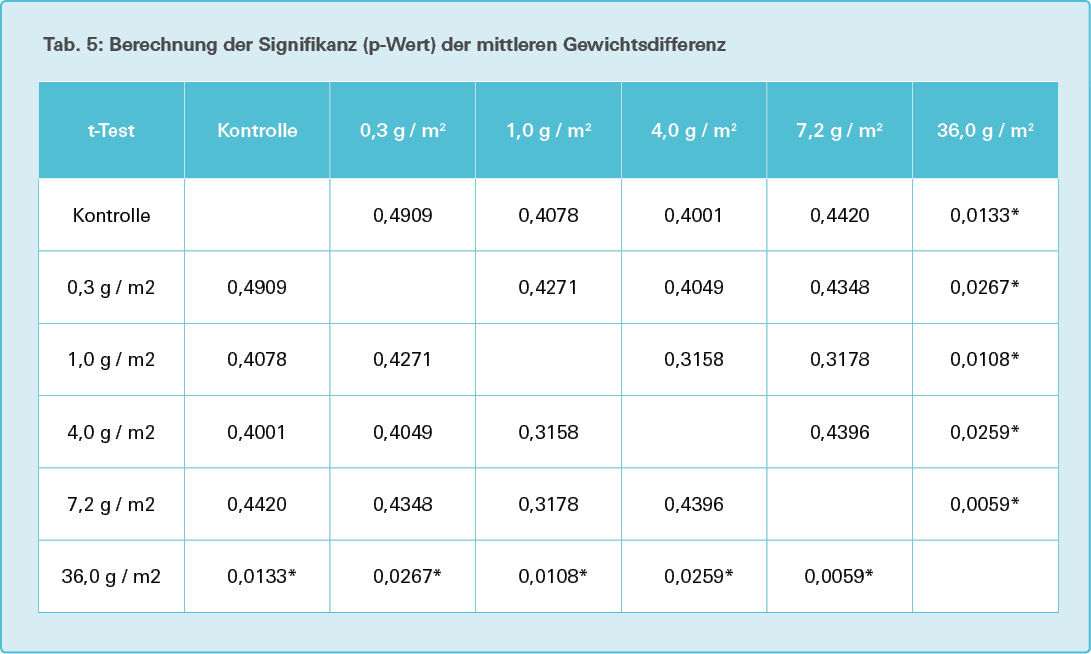
Sowohl in den Kontroll- als auch in den Versuchsgruppen kommt es zu einer Gewichtszunahme von etwa 50 % gegenüber dem Ausgangsgewicht während der 28-tägigen Versuchsdauer (siehe Tab. 2). Nur die 36,0-g/m2-Versuchsgruppe weist einen signifikanten Unterschied sowohl zu der Kontrollgruppe als auch zu den anderen Versuchsgruppen auf (p < 0,05), siehe Tab. 5.
Nach 10-minütigem Erhitzen befinden sich alle Jungwürmer einer Gruppe auf der Oberfläche des Grundsubstrats. Die gefundenen Jungwürmer weisen eine Länge zwischen 0,5 cm und 6,0 cm auf. Die mittlere Anzahl der nach 56 Tagen pro Versuchsgefäß gefundenen Jungtiere ist in Tab. 6 enthalten.
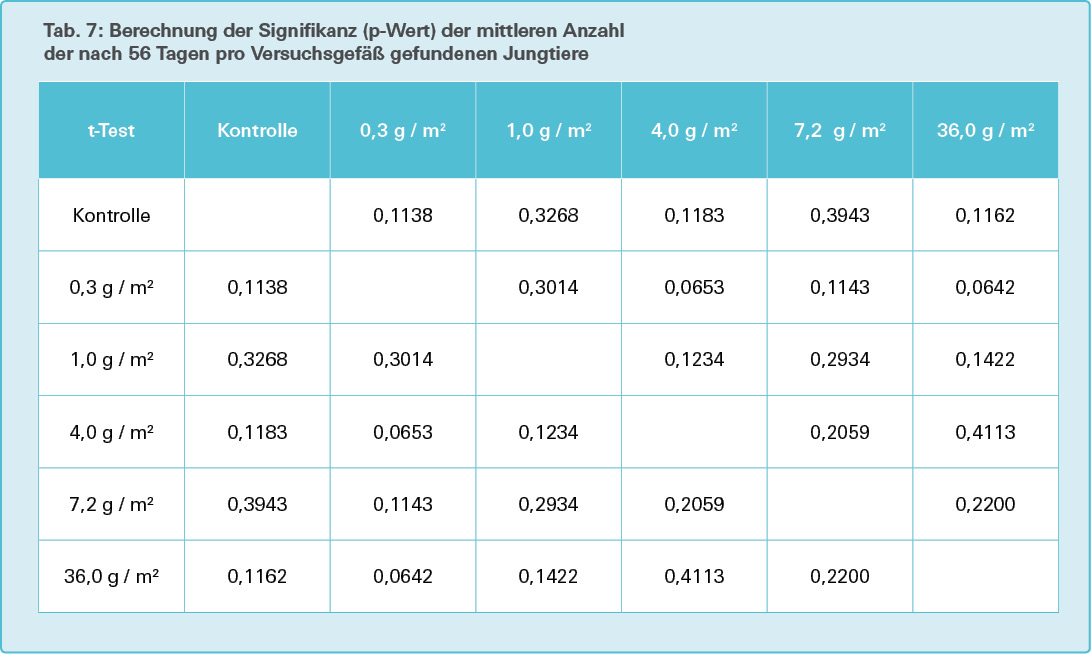
Die Anzahl der Jungwürmer in den Versuchsgruppen weisen keinen signifikanten Unterschied zu denen der Kontrollgruppe auf (in jedem der Gruppenvergleiche p > 0,05), siehe Tab. 7.
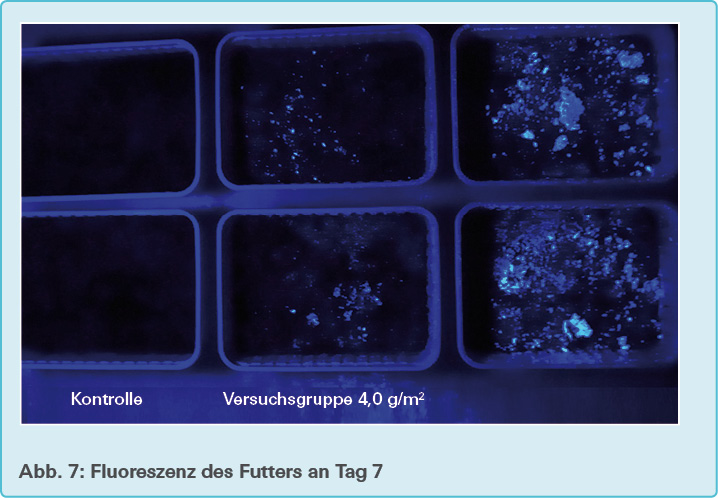
Innerhalb des Beobachtungszeitraums von sieben Tagen treten keine signifikanten Gewichtsänderungen sowohl innerhalb einer Gruppe als auch zwischen den drei verschiedenen Gruppen auf. Visuell nimmt die Fluoreszenz des Futters auf der Substratoberfläche innerhalb der sieben Tage ab (siehe Abb. 6 und Abb. 7). Die Versuchstiere in allen Versuchsgruppen zeigen nach einer Woche im Fluoreszenzlicht keine Fluoreszenz (siehe Abb. 8), wohingegen einen Tag nach Umsetzen der Versuchstiere in reines Grundsubstrat der auf der Oberfläche abgelagerte Kot in der Versuchsgruppe 4,0 g/m2 eine leichte, in der Versuchsgruppe 36,0 g/m2 eine deutliche Fluoreszenz zeigt (siehe Abb. 9).
Während es für das aquatische Ökosystem vielfältige Nachweise für die Schädlichkeit von Mikroplastik gibt [1], liegen bislang kaum Erkenntnisse über deren Effekt im terrestrischen Ökosystem vor.
Ziel dieser Arbeit war es, die Auswirkungen von Mikroplastik-Partikeln einer Kunststoffart – in diesem Fall Polypropylen – auf ein spezifisches, in der ökotoxikologischen Testung häufig angewandtes Testsystem, den Kompostwurm Eisenia fetida, zu untersuchen.
Die formulierte Hypothese lautet, dass unter dem Einfluss der Mikroplastik- Partikel sich ein oder mehrere spezifische Testparameter im Sinne einer Schädigung auf Eisenia fetida pathologisch verändern.
Der am wenigsten spezifische Parameter, die Fraßrate, hat eine geringe Aussagekraft, da die Menge des verbrauchten Futters (in Form von auf die Oberfläche des Grundsubstrats aufgestreuten gemahlenen Dungs) nicht quantitativ erfassbar ist. Ein weiterer Parameter stellt die Mortalität dar. Nach der OECD-Richtlinie 222 sollte die Menge der zu testenden toxischen Substanz so bemessen sein, dass im Beobachtungszeitraum von 56 Tagen keines der eingesetzten adulten Tiere stirbt. Exakter zu bestimmen ist der Parameter Gewichtsdifferenz. Da die jeweils zehn eingesetzten adulten Würmer nicht individuell gekennzeichnet werden können (mögliche potenzielle Schädigung durch eine Markierung nicht auszuschließen), kann die Gewichtsveränderung nur jeweils pro Versuchsgefäß und damit nur je 10 Würmer ermittelt werden. Als sensitivster Parameter gilt die Fertilitätsrate, da diese schon durch vergleichsweise geringe Schädigung des Testorganismus Eisenia fetida beeinflusst wird.
In den durchgeführten Experimenten wurde keiner der vier Parameter durch steigende Mikroplastik-Konzentrationen negativ verändert. In allen Versuchsgruppen war die Fraßrate gleich. Auch bei der Mortalitätsrate, die in allen Gruppen null Prozent betrug, gab es keinen Unterschied zu verzeichnen.
Die Wurm-Ausgangsgewichte zu Versuchsbeginn betrugen minimal 0,183 g, maximal 0,616 g und liegen damit weitgehend im zu erwartenden Bereich von 0,2 bis 0,6 g (M. Ganßmann, Study Director, Fa. IBACON, persönliche Mitteilung). Die mittleren Ausgangsgewichte pro Versuchsansatz von je 10 adulten Würmern lagen zwischen 0,348 g und 0,412 g und wiesen keinen signifikanten Unterschied auf.
Bei den Wurm-Endgewichten nach 28 Tagen zeigte dagegen die Versuchsgruppe mit der höchsten Mikroplastikexposition gegenüber drei anderen Versuchsgruppen (0,3 g/m2, 1,0 g/m2 und 7,2 g/m2) einen signifikant höheren Gewichtszuwachs. Gegenüber der Kontrollgruppe und der 4,0-g/m2-Versuchsgruppe verfehlte der Gewichtszuwachs nur knapp das Signifikanzniveau von 5 %.
Bei der Ermittlung der Gewichtsdifferenzen zwischen Ausgangs- und Endgewicht wiesen alle Versuchsgruppen eine etwa 50-prozentige Gewichtszunahme auf. Die 36,0-g/m2-Versuchsgruppe zeigte gegenüber allen anderen Versuchsgruppen eine signifikant höhere Gewichtszunahme. Wenn man die nicht signifikant höheren Gewichtsdifferenzen der niedrigeren Versuchsgruppen (Ausnahme 0,3-g/m2-Versuchsgruppe) berücksichtigt, ergibt sich eine diskrete Dosis-Wirkungsbeziehung, das heißt, eine höhere Gewichtszunahme mit steigender Mikroplastik-Exposition.
Eine mögliche Ursache für diese Beobachtung könnte sein, dass – anders als in Daphnien – das Mikroplastik im größeren Gastrointestinalsystem des Wurms nicht zu einer Verstopfung und damit zum Verhungern führt, sondern dass es sich im Darm an der Darmwand anlagert oder in Ausbuchtungen ablagert und so das Wurmgewicht erhöht, ohne die Fraßrate des Wurms zu beeinflussen. Auch eine Verzögerung der Darmentleerung durch mechanische Verstopfung oder Beeinflussung der Darmperistaltik kämen in Frage.
Eine Kontrolle der Aufnahme des zugegebenen Mikroplastiks war nicht möglich, zum einen wegen der geringen Menge (einmalig 5,8 bis 684,0 mg Mikroplastik versus vier mal 5000 mg Futter), zum anderen, weil bereits beim Aufbringen des zweiten Futterdungs das gegebenenfalls noch nicht aufgenommene Mikroplastik vollständig überdeckt wurde.
Da ein direkter Nachweis des eingesetzten Mikroplastiks im Kot aufgrund der sehr geringen Konzentrationen nicht möglich ist, wurde zur Untersuchung, ob die höhere Gewichtszunahme der Würmer unter steigender Mikroplastik-Konzentration auf ein Verbleiben des Mikroplastiks im Darm zurückzuführen ist, fluoreszierendes Mikroplastik (Polyamid) dem Futter zugesetzt und die Versuchstiere nach sieben Tagen fluoreszenzmikroskopisch untersucht. Die Würmer selbst zeigten im Fluoreszenzlicht keine Anreicherung von Mikroplastik im Körper. Nach Umsetzen in reines Grundsubstrat konnte nach 24 Stunden eine dosisabhängige Fluoreszenz auf der Oberfläche als Zeichen einer Ausscheidung des markierten Polyamids nachgewiesen werden. Dies lässt darauf schließen, dass Mikroplastik nicht im Darm akkumuliert wird und daher, zumindest bei Eisenia fetida, auch nur ein geringes Wirkpotenzial hat.
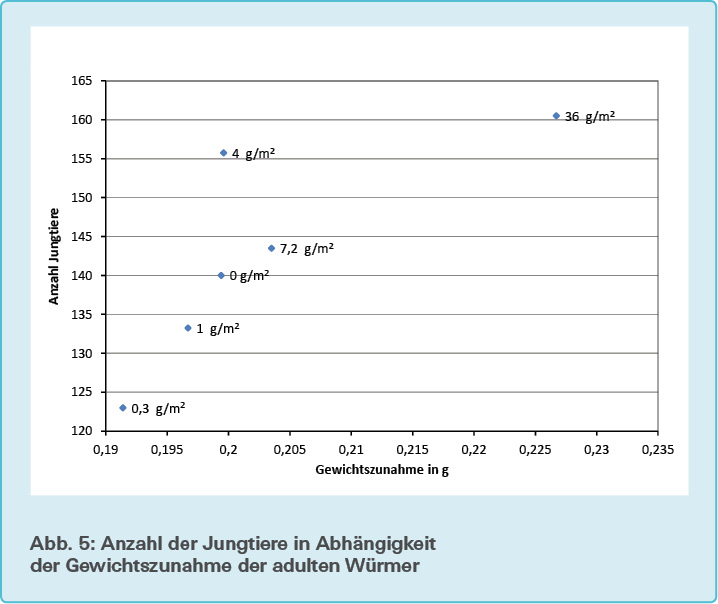
Die festgestellte positive Korrelation zwischen Wurmgewicht und Fertilitätsrate entspricht zunächst den unter natürlichen Bedingungen zu erwartenden Ergebnissen. Die Tatsache, dass die Fertilitätsrate eine leichte, wenn auch nicht signifikante Korrelation zwischen steigender Mikroplastikgabe und steigender Anzahl von Jungwürmern zeigte, könnte Hinweis darauf sein, dass Mikroplastik in den Hormonhaushalt des Wurmes eingreift.
Dabei könnte Mikroplastik eine direkte Wirkung ausüben oder eine indirekte durch an das Mikroplastik adsorbierte chemische Substanzen. Eine solche Wirkung wurde zum Beispiel im Humanbereich für die Substanz Bisphenol A nachgewiesen, einem Weichmacher in verschiedenen Kunststoffarten. In den an Eisenia fetida durchgeführten Experimenten könnte eine Hormonwirkung zu einem gesteigerten Appetit sowie zu einer erhöhten Paarungsbereitschaft führen, auch wenn andere Wirkmechanismen, wie beispielsweise eine durch die Mikroplastik-Partikel induzierte verstärkte Nahrungsaufnahme ebenfalls relevant sein können. Inwieweit dann die zu beobachtende Gewichtszunahme sowie die tendenziell zu beobachtende Zunahme der Fertilitätsrate für den Wurm auch langfristig positive oder gegebenenfalls negative Effekte sind, müsste durch Langzeit-Experimente untersucht werden. Im Pflanzenreich gibt es Beispiele, dass Bäume unter Stressbedingungen vermehrt Früchte zur Fortpflanzung bilden.
Kunststoffe im Allgemeinen und Mikroplastik im Speziellen stellen eine Gefahr für die Umwelt dar. Dies konnte im aquatischen Ökosystem, beispielsweise an Daphnien, gezeigt werden. Es ist davon auszugehen, dass die Gefährdung der Tierarten durch Mikroplastik und Plastik je nach Organismusgröße von den Konzentrationen und der Einwirkungsdauer abhängt.
Die Hypothese einer schädigenden Wirkung durch Mikroplastik auf einen terrestrischen Testorganismus wie Eisenia fetida konnte durch diese Experimente nicht bestätigt werden. Mögliche Ursachen sind:
- Ein zu großer Testorganismus im Verhältnis zur Partikelgröße des Mikroplastiks. Vor allem kleinere Bodenorganismen mit einem kleineren Gastrointestinalsystem könnten davon betroffen sein, indem sie durch Mikroplastik-Partikel Verstopfungen erleiden und ähnlich wie die Daphnien im aquatischen System dadurch verhungern. Dies könnte man mithilfe eines alternativen Testsystems, wie z. B. Collembola spec. untersuchen.
- Ein phylogenetisch zu einfaches Gastrointestinalsystem mit einer sehr kurzen Transitzeit könnte zu einer zu geringen Einwirkdauer des Mikroplastiks auf den Versuchstierorganismus führen. Durch Einsatz einer alternativen Versuchstierspezies mit komplexerem Darmaufbau, wie z. B. Larven des Rosenkäfers (Cetoniidae), könnte diese Hypothese verfolgt werden.
- Eine zu geringe Mikroplastik-Konzentration bzw. eine zu kurze Mikroplastik- Exposition. Durch Versuche mit höheren Konzentrationen, entweder als Einzelgabe oder bei jeder Fütterung oder durch eine Verlängerung der Versuchsdauer könnten mögliche Langzeitfolgen des Mikroplastiks auf den Testorganismus erkannt werden.
- Die Wahl einer nicht ausreichend toxischen Kunststoffart. Polypropylen gehört zwar zu den am häufigsten vorkommenden Kunststoffen im Klärschlamm, möglicherweise wirken aber andere, in geringerer Menge vorkommende Kunststoffe, wie z. B. Polyvinylchlorid, toxischer auf Organismen des terrestrischen Ökosystems.
- Ein weiterer interessanter Ansatz wäre die Untersuchung der Auswirkung von Biokunststoffen, dessen Verwendung im Alltag zurzeit getestet und kritisch diskutiert wird.
Ich möchte mich ganz herzlich bei Matthias Ganßmann, Study Director der Firma Ibacon, Dr. Ing. Lutz Härtel, Unger Ingenieure, Professor Gerhard Schulz, Universität Reutlingen, Dr. Christa Jansen, Schulförderung der Firma Merck sowie bei Oberstudiendirektor Heinz-Jürgen Krell, Direktor der Eleonoren-Schule Darmstadt, für ihre Unterstützung bedanken. Mein ganz besonderer Dank gilt meiner Betreuerin Studiendirektorin Martina Gerbig- Gross.
[1] Arthur, C.; Baker, J. & H. Bamford (2009): Proceedings of the international Research Workshop on the Occurrence, Effects and Fate of Microplastic Marine Debris. Sept 9-11, 2008. NOAA Technical Memorandum NOS-QR&R-30.
[2] Browne, M.A.; Crump, P.; Niven, S.J.; Teuten, E.; Tonkin, A.; Galloway, T. & R. Thompson (2011): Accumulation of Microplastic on Shorelines Worldwide: Sources and Sinks. Environmental Science & Technology 45: 9175-9179
[3] OECD Guideline 222 for Testing of Chemicals – Earthworm Reproduction Test Eisenia fetida / Eisenia andrei), 13. April 2004.
[4] STERN-Report „Rettet den Boden“, 1985, S. 20.
[5] Teuten, E.L., Rowland, S.J., Galloway, T.S. & Richard C. Thompson (2007): Potential for plastics to transport hydrophobic contaminants. Environmental Science and Technology 41, 7759-7764.
[6] Wright, S. L., Thompson, R. & T. S. Galloway (2013): The physical impacts of microplastics on marine organisms: A review. In: Environmental Pollution 177, S. 483–492.
[7] http://www.awi.de/de/news/press_releases/ detail/item/microplastics_in_the_ marine_environment?cHash=14eb514eeb38733b438f05e18ede7cf7 (12.12.2014)
[8] http://www.bmel.de/DE/Landwirtschaft/ JahrdesBodens/JahrdesBodens_ node.html (20.12.2014)
[9] http://www.expeditionmed.eu/fr/en/ programme-general/ ( 5.12.2014)
[10] http://www.geodz.com/deu/d/images/1979_ terrestrische_oekosysteme.png (19.11.14)
[11] http://www.matheguru.com/stochastic/ 267-t-Test.html (8.4.2015)